Клонирование – это процесс создания уменьшенных копий растения, путем срезания с него черенков. Это один из наиболее легких, а главное, финансово не затратных способов пополнить свою оранжерею. Все что для этого требуется – наличие уже взрослого растения, находящегося в стадии вегетации.
Со временем клон обзаведется своими собственными корнями, и станет самодостаточным растением. Любой клон обладает идентичным набором генов, что и растение, с которого его срезали. Например, если материнское растение было женского пола, то и клон гарантировано будет женского. Это означает, что растениевод сможет получить такое же количество урожая с идентичными вкусоароматическими качествами и количественным содержанием активных веществ.
Преимущества клонирования
Клонирование представителей флоры открывает перед гроверами следующие преимущества:
- Поскольку клон является точно копией материнского растения, то он будет расти и развиваться точно так же. Это касается и всех остальных клонов, срезанных с этой же культуры. Все они будут как близнецы;
- Растениевод будет знать все о растении, которое выросло из клонов, поскольку он уже вырастил материнский куст;
- Из одного материнского куста можно сделать большое количество клонов;
- Клоны являются более сильными и жизнеспособными, нежели рассада. Это значит, что они с большой вероятностью превратятся в полноценное растение, а также будут развиваться быстрее;
- С помощью клонирования можно получить значительно большее количество урожая, нежели с одного. Для этого необходимо применить технику повышения урожайности растений «Sea Of Green»;
- С помощью клонирования гровер сможет сохранить генетику понравившегося растения с гарантией полной идентичности не только самих растений, но и урожая, который они принесут.
Процесс клонирования растений
Срезание черенка
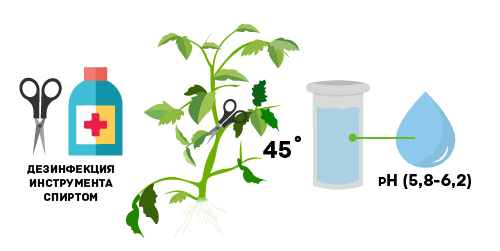
Для отделения черенка понадобится острый режущий предмет. Можно использовать маникюрные ножницы, триммер или обыкновенное лезвие. Перед применением его непременно нужно продезинфицировать, чтобы патогенные бактерии не атаковали растение. Для этого можно использовать обыкновенный спирт.
Срез рекомендуется делать исключительно на молодых и здоровых побегах, имеющих светло-зеленую листву. Также нужно срезать черенки с нижних ветвей, поскольку они содержат больше гормонов, участвующих в корнеобразовании, а потому быстрее пускают корни. Сам срез необходимо делать в месте ответвления черенка от побега. Его длина должна быть в пределах между 10 и 20 сантиметрами.
Срез делается под углом в 45 градусов, чтобы создать самую благоприятную площадь внутренней части клона, из которой впоследствии начнет развиваться корневая система. Далее черенок нужно немедленно поместить в емкость с водой, оптимальной по уровню pH (5,8-6,2). Это делается для того, чтобы предотвратить его заражение болезнетворными бактериями, дать ему жизненно необходимую влагу, а также предотвратить начало заживления раны, которое начинается при контакте с кислородом.
Укоренение клонов
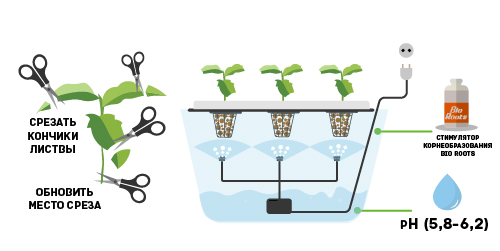
Перед началом укоренения с ростка необходимо срезать всю листву. Это необходимо сделать для того, чтобы растение больше ориентировалось на развитие корневой массы, нежели надземной части. Если место среза начало затягиваться, то желательно его обновить, отрезав еще несколько миллиметров стебля.
Добиться быстрого прорастания корней можно несколькими способами. Черенки способны пускать корни в обычной воде, находясь в ней в течение 1-2 недель. Многие гроверы так и делают, пересаживая их после этого в субстрат. Однако такие действия неактуальны, поскольку можно достичь гораздо лучших результатов, поместив их в питательный раствор.
Для приготовления питательного раствора необходимо добавить в воду, с отрегулированным уровнем рН, стимулятор корнеобразования. Отлично зарекомендовал себя в этой роли препарат Bio Roots. В его составе присутствуют только растительные экстракты, полученные из масел и плодов. Применение препарата позволяет укрепить защитный слой, сформировавшийся на конце корня, а также сделать пространство вокруг корневой системы более благоприятной для развития. В результате удается добиться улучшения адаптационного процесса, что положительно сказывается на времени укоренения и самом процессе в целом.
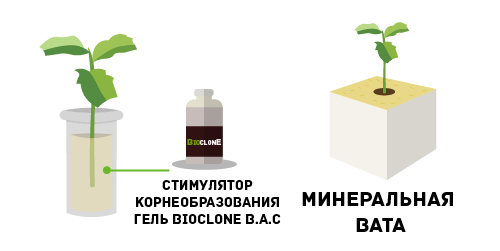
Второй способ укоренения немного отличается от первого. Он подразумевает использование специального геля – стимулятора корнеобразования. В него на некоторое время помещается место среза, после чего черенок переносят в субстрат. Рекомендуем использовать гель Bioclone B.A.C. Он обеспечивает быстрый старт началу формирования корневой системы у черенков в субстрате, а также бурное ее развитие. Средство также защищает место среза от инфекций, плесени и бактерий. В качестве субстрата для высадки лучше всего использовать кокосовое волокно или минеральную вату. Они являются стерильной благоприятной средой для развития корневой системы.
Благоприятная среда
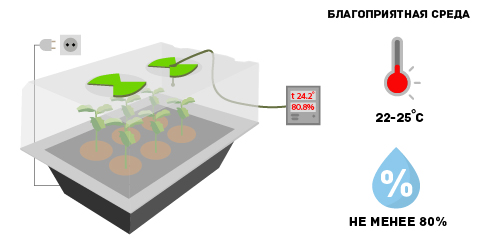
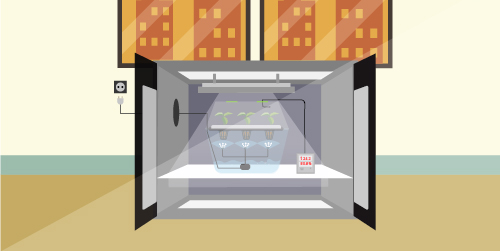
Вне зависимости от того, каким способом укоренения клонов воспользовался растениевод, им необходимо создать благоприятную среду для жизни. Для этой цели идеальным вариантом станет аэропонная система-пропагатор X-Stream 40. Благодаря ей процесс черенкования протекает значительно быстрее. Все что требуется — это разместить клоны в камере увлажнения, поместив их в специальные выемки. Установка обеспечит непрерывное орошение корневой зоны питательным раствором. Температуру и уровень влажности можно будет регулировать самостоятельно, используя специальные клапаны, находящиеся в крышке пропагатора. Его корпус выполнен из прозрачного материала, позволяющего визуально контролировать процесс.
Оптимальный микроклимат
Уровень влажности должен быть не менее 80%. Такие высокие показатели объясняются тем, что пока корневая система клонов не сформирована окончательно, они получают воду только через листву и стебли. Оптимальной температурой считается показатель в 22-25 градусов, однако для некоторых представителей флоры она может быть и выше.
Освещение клонов
Во время того, когда клоны еще находятся на стадии укоренения, они не нуждаются в мощном освещении. На данном этапе рекомендуется не использовать яркие LED или ДНаТ лампы. Следует подождать, пока клон не станет полноценным растением, перешедшем в стадию вегетации.
Наилучшим вариантом для освещения клонов являются энергосберегающие или флуоресцентные лампы с широким спектральным диапазоном испускаемого света. Такие источники света легко монтируются и потребляют мало электричества. Отличным вариантом станет флуоресцентная лампа TNeon 9500K «Cutting», созданная специально для этих целей. Ее свет стимулирует деление растительных клеток, ускоряя рост зеленой массы и корневой системы. Все благодаря свету с цветовым диапазоном в 9500 К, который благоприятно влияет на стадии проращивания. Данная модель отличается длительным сроком эксплуатации и выделяет малое количество тепла при работе.
Лампу рекомендуется использовать совместно со светильником TNeon 2х55 W. Он изготовлен из металлического листа, покрытого устойчивым лакокрасочным материалом белого цвета, обеспечивающим высокий уровень отражаемости светового потока. На верхней части корпуса присутствуют крючки для подвешивания прибора. Внутри него установлено два патрона для флуоресцентных ламп, имеющих цоколь 2G11, и стандартный трехконтактный разъем для питания. Светильник имеет электронный балласт для двух ламп мощностью в 55 Вт.
Что касается светового режима, то он должен быть установлен в значении 16/8 или 18/6. Это обусловлено тем, что корневая система клонов активно развивается в темное время суток. При таком освещении и достаточном количестве кислорода черенки будут получать достаточное количество жизненной энергии для здорового роста и стремительного развития.
Несколько простых советов от бывалых гроверов
- Всегда старайтесь держать листву влажной, ведь на данном этапе жизни черенки получают воду именно через нее;
- Подкармливать черенки можно небольшим количеством витамина В-1, калием и азотом;
- Брать клоны следует только со здоровых и крепких растений;
- Для быстрого укоренения срезать черенки следует с нижней половины растения;
- Всегда следует брать больше клонов, чем нужно, поскольку не всем будет суждено превратиться в полноценное растение;
- Подписывайте каждого клона, указывая материнское растение, с которого он был срезан, а также дату его создания.
Работа TDS метра основана на электропроводности водной – электроды, погруженные в водную среду, создают между собой электрическое поле. Чистая дистиллированная вода сама по себе ток не проводит, образуют его растворенные в воде различные примеси и соединения.
Солемер или TDS метр – это стационарный малогабаритный прибор для измерения жесткости воды и процентного содержания в ней разного вида веществ.
Кокосовый субстрат, изготавливаемый из растертой в мелкую крошку кожуры и волокон кокосового ореха, − достаточно молодой материал.
Чтобы пересаженные цветы хорошо росли и развивались, их корням необходима влага и возможность дышать через земляную почву. Обычная земляная смесь представляет собой достаточно плотную субстанцию, плохо пропускающую живительную влагу и воздух к корням.
Керамзитовый дренажный материал или керамзит – это одна из разновидностей субстрата применяемая для укоренения черенков роз гвоздик и иных цветочных растений.
В прошлом веке ученые открыли вещества, влияющие на работу тех или иных функций растения. С помощью этих веществ, каждый садовод может повлиять на жизненный цикл растения, ускорить или замедлить его развитие. Подобные вещества называют стимуляторами роста.
Современные технологии позволяют контролировать развитие растений по воле человека. Еще в 20 веке ученые открыли фитогормоны, вещества, стимулирующие все процессы жизнедеятельности и контролирующие их протекание
При выращивании растений без солнечных лучей нужно сильно постараться, чтоб предоставить все необходимое. Ведь питается растение именно световыми лучами, без которых рост и развитие невозможно, грунт и удобрение играют второстепенную роль.
- Интернет магазин ООО «АгроДом»
- Страна: Россия
- E-mail: [email protected]
- Телефон: 8 (800) 555–42–84
- Мы работаем: пн-пт 9:00–23:00; сб 10:00–21:00; вс 12:00-20:00
Узнайте первым о предстоящих акциях и скидках. Мы не рассылаем спам и не передаем email третьим лицам
05 февраля 2013
Микроклональное размножение растений
Микроклональное размножение растений — один из способов вегетативного размножения в условиях «in vitro».
Для семенных растений характерно два способа размножения: семенной и вегетативный. Оба эти способа имеют как преимущества, так и недостатки. К недостаткам семенного размножения следует отнести, в первую очередь, генетическую пестроту получаемого посадочного материалa и длительность ювенильного периода. При вегетативном размножении сохраняется генотип материнского растения и сокращается продолжительность ювенильного периода. Однако для большинства видов (в первую очередь для древесных пород) проблема вегетативного размножения остается до конца не решенной.
Это обусловлено следующими причинами:
— не все породы, даже на ювенильной стадии, могут размножаться вегетативным способом с требуемой эффективностью (дуб, сосна, ель, орехоплодные и др.);
— практически невозможно с помощью черенкования размножать многие виды древесных пород в возрасте старше 10—15 лет;
— не всегда удается получать стандартный посадочный материал (возможность накопления и передачи инфекции);
— трудоемкостью и сложностью операций при размножении взрослых (древесных) растений с помощью прививок;
— неэффективностью разработанных технологий для получения достаточного количества генетически однородного материала в течение года.
Достижения в области культуры клеток и тканей привели к созданию принципиально нового метода вегетативного размножения — клонального микроразмножения (получение в условиях in vitro (в пробирке), неполовым путем растений, генетически идентичных исходному экземпляру). В основе метода лежит уникальная способность растительной клетки реализовывать присущую ей тотипотентность, то есть под влиянием экзогенных воздействий давать начало целому растительному организму.
Этот метод, несомненно, имеет ряд преимуществ перед существующими традиционными способами размножения:
— получение генетически однородного посадочного материала;
— освобождение растений от вирусов за счет использования меристемной культуры;
— высокий коэффициент размножения (105—106 — для травянистых, цветочных растений, 104—105 — для кустарниковых древесных, 104 — для хвойных);
— сокращение продолжительности селекционного процесса;
— ускорение перехода растений от ювенильной к репродуктивной фазе развития;
— размножение растений, трудно размножаемых традиционными способами;
— возможность проведения работ в течение года и экономия площадей, необходимых для выращивания посадочного материала;
Первые достижения в области клонального микроразмножения были получены в конце 50-х годов XX столетия французским ученым Жоржем Морелем, которому удалось получить первые растения-регенеранты орхидей. Успеху Ж. Мореля в микроразмножении способствовала уже разработанная к тому времени техника культивирования апикальной меристемы растений в условиях in vitro. Как правило, исследователи в качестве первичного экспланта использовали верхушечные меристемы травянистых растений: гвоздики, хризантемы, подсолнечника, гороха, кукурузы, одуванчика, салата и изучали влияние состава питательной среды на процессы регенерации и формирования растений. Ж. Морель в своих работах также использовал верхушку цимбидиума (сем. орхидные) состоящую из конуса нарастания и двух-трех листовых зачатков, из которой при определенных условиях наблюдал образование сферических сфер — протокормов. Сформировавшиеся протокормы можно было делить и затем культивировать самостоятельно на вновь приготовленной питательной среде до образования листовых примордиев и корней. В результате им было обнаружено, что этот процесс бесконечен и можно было получать в большом количестве высококачественный и генетически однородный, безвирусный посадочный материал.
В России работы по клональному микроразмножению были начаты в 60-х годах в лаборатории культуры тканей и морфогенеза Института физиологии растений им. К. А. Тимирязева РАН. Под руководством чл.-корр. РАН, академика РАСХН Бутенко Р. Г. были изучены условия микроразмножения картофеля, сахарной свеклы, гвоздики, герберы, фрезии и некоторых других растений и предложены промышленные технологии. Таким образом, первые успехи в клональном микроразмножении связаны с культивированием апикальных меристем травянистых растений на соответствующих питательных средах, обеспечивающих в конечном итоге получение растений-регенерантов.
Однако область применения микроразмножения разнообразна и имеет тенденцию к постоянному расширению. Это в первую очередь относится к размножению in vitro взрослых древесных пород, особенно хвойных, и использование техники in vitro для сохранения редких и исчезающих видов лекарственных растений. В настоящее время в этом направлении наметился положительный сдвиг.
Первые работы по культуре тканей древесных растений были опубликованы в середине 20-х годов XX столетия и связаны с именем французского ученого Готре.
В них сообщалось о способности камбиальных тканей некоторых видов вяза и сосны к каллусогенезу in vitro. В последующих работах 40-х годов было выяснено о способности различных тканей вяза листового к образованию адвентивных почек. Однако дальнейший рост и формирование побегов авторами не были получены. Лишь к середине 60-х годов Матесу удалось получить первые растения-регенеранты осины, которые были доведены до почвенной культуры. Культивирование тканей хвойных город in vitro долгое время использовалось как объект исследования. Это было связано со специфическими трудностями культивирования ювенильных и тем более взрослых тканей, изолированных с растения. Известно, что древесные, и особенно хвойные, характеризуются медленным ростом, трудно укореняются, содержат большое количество вторичных соединений (фенолы, терпены и другие вещества), которые в изолированных тканях окисляются различными фенолазами. В свою очередь, продукты окисления фенолов обычно ингибируют деление и рост клеток что ведет к гибели первичного экспланта или к уменьшению способности тканей древесных пород к регенерации адвентивных почек которая с возрастом растения-донора постепенно исчезает полностью. Однако, несмотря на все трудности, ученые все чаще используют в качестве объектов исследований различные ткани и органы древесных растений В настоящее время насчитывается более 200 видов древесных растений из 40 семейств, которые были размножены in vitro (каштан, дуб, береза, клен, осина, гибриды тополей с осиной, сосна, ель, секвойя и др.), а работы в этом направлении ведутся в научных учреждениях Москвы, Санкт-Петербурга, Воронежа, Уфы, Новосибирска, Архангельска, Киева, Одессы, Ялты и др.
Этапы микроклонального размножения растений
Процесс клонального микроразмножения можно разделить на 4 этапа:
1. Выбор растения-донора, изолирование эксплантов и получение хорошо растущей стерильной культуры.
2. Собственно микроразмножение, когда достигается получение максимального количества меристематических клонов.
3. Укоренение размноженных побегов с последующей адаптацией их к почвенным условиям, а при необходимости депонирование растений-регенерантов при пониженной температуре (+2оС, +10оС).
4. Выращивание растений в условиях теплицы и подготовка их к реализации или посадке в поле.
Для культивирования тканей на каждом из четырех этапов требуется применение определенного состава питательной среды.
На первом этапе необходимо добиться получения хорошо растущей стерильной культуры. В тех случаях, когда трудно получить исходную стерильную культуру экспланта, рекомендуется вводить в состав питательной среды антибиотики (тетрациклин, бензилпенициллин и др.) в концентрации 100—200 мг/л. Это в первую очередь относится к древесным растениям, у которых наблюдается тенденция к накоплению внутренней инфекции.
На первом этапе, как правило, используют среду, содержащую минеральные соли по рецепту Мурасига и Скуга, а также различные биологически активные вещества и стимуляторы роста (ауксины, цитокинины) в различных сочетаниях в зависимости от объекта. В тех случаях, когда наблюдается ингибирование роста первичного экспланта, за счет выделения им в питательную среду токсичных веществ (фенолов, терпенов и других вторичных соединений), снять его можно, используя антиоксиданты. Это возможно двумя способами: либо омывкой экспланта слабым его раствором в течение 4—24 ч, либо непосредственным добавлением в питательную среду. В качестве антиоксидантов используют: аскорбиновую кислоту (1 мг/л), глютатион (4—5 мг/л), дитиотриэтол (1—3 мг/л), диэтилдитиокарбомат (2—5 мг/л), поливинилпирролидон (5000—10000 мг/л). В некоторых случаях целесообразно добавлять в питательную среду адсорбент — древесный активированный уголь в концентрации 0,5—1%. Продолжительность первого этапа может колебаться от 1 до 2 месяцев, в результате которого наблюдается рост меристематических тканей и формирование первичных побегов.
2 этап — собственно микроразмножение. На этом этапе необходимо добиться получения максимального количества мериклонов, учитывая при этом, что с увеличением субкультивирований увеличивается число растений-регенерантов с ненормальной морфологией и возможно наблюдать образование растений-мутантов.
Как и на первом этапе, используют питательную среду по рецепту Мурасига и Скуга, содержащую различные биологически активные вещества, а также регуляторы роста. Основную роль при подборе оптимальных условий культивирования эксплантов играют соотношение и концентрация внесенных в питательную среду цитокининов и ауксинов. Из цитокининов наиболее часто используют БАП в концентрациях от 1 до 10 мг/л, а из ауксинов—ИУК и НУК в концентрациях до 0,5 мг/л.
При долгом культивировании растительных тканей на питательных средах с повышенным содержанием цитокининов (5—10 мг/л) происходит постепенное накопление их в тканях выше необходимого физиологического уровня, что приводит к появлению токсического действия и формированию растений с измененной морфологией. Вместе с тем, возможно наблюдать такие нежелательные для клонального микроразмножения эффекты, как подавление пролиферации пазушных меристем, образование витрифицированных (оводненных) побегов и уменьшение способности растений к укоренению. Отрицательное действие цитокининов возможно преодолеть, по данным Н.В. Катаевой и Р.Г. Бутенко, путем использования питательных сред с минимальной концентрацией цитокининов, обеспечивающих стабильный коэффициент микроразмножения, или путем чередования циклов культивирования на средах с низким и высоким уровнем фитогормонов.
3 и 4 этапы — укоренение микропобегов, их последующая адаптация к почвенным условиям и высадка в поле являются наиболее трудоемкими этапами, от которых зависит успех клонального микроразмножения. На третьем этапе, как правило, меняют основной состав среды: уменьшают в два, а иногда и в четыре раза концентрацию минеральных солей по рецепту Мурасига и Скуга или заменяют ее средой Уайта, уменьшают количество сахара до 0,5—1% и полностью исключают цитокинины, оставляя один лишь ауксин. В качестве стимулятора корнеобразования используют β-индолил-3-масляную кислоту (ИМК), ИУК или НУК.
Укоренение микропобегов проводят двумя способами:
1) выдерживание микропобегов в течение нескольких часов (2—24 ч) в стерильном концентрированном растворе ауксина (20—50 мг/л) и последующее их культивирование на агаризованной среде без гормонов или непосредственно в подходящем почвенном субстрате (импульсная обработка);
2) непосредственное культивирование микропобегов в течение 3—4 недель на питательной среде, содержащей ауксин в невысоких концентрациях (1—5 мг/л в зависимости от исследуемого объекта). В последнее время предложен метод укоренения пробирочных растений в условиях гидропоники. Этот метод позволяет значительно упростить этап укоренения и одновременно получать растения, адаптированные к естественным условиям. Для картофеля возможно использовать безсубстратную гидропонику для получения мини-клубней. Затенение нижней части культуральных сосудов плотной черной материей или добавление в питательную среду активированного угля способствует укоренению микропобегов.
Пересадка растений-регенерантов в субстрат является ответственным этапом, завершающим процесс клонального микроразмножения. Наиболее благоприятное время для пересадки пробирочных растений — весна или начало лета.
Растения с двумя-тремя листьями и хорошо развитой корневой системой осторожно вынимают из колб или пробирок пинцетом с длинными концами или специальным крючком. Корни отмывают от остатков агара и высаживают в почвенный субстрат, предварительно простерилизованный при 85—90° С в течение 1—2 ч. Для большинства растений в качестве субстратов используют торф, песок (3:1); торф, дерновую почву, перлит (1:1:1); торф, песок, перлит (1:1:1). Исключение составляют семейство орхидных, для которых готовят субстрат, состоящий из сфагнового мха, смеси торфа, листьев бука или дуба, сосновой коры (1:1:1).
Приготовленным заранее почвенным субстратом заполняют пикировочные ящики или торфяные горшочки, в которых выращивают растения-регенеранты. Горшочки с растениями помещают в теплицы с регулируемым температурным режимом (20—22° С), освещенностью не более 5 тыс. лк и влажностью 65—90%. Для лучшего роста растений создают условия искусственного тумана. В тех случаях, когда нет возможности создать такие условия, горшочки с растениями накрывают стеклянными банками или полиэтиленовыми пакетами, которые постепенно открывают до полной адаптации растений.
Через 20—30 дней после посадки хорошо укоренившиеся растения подкармливают растворами минеральных солей Кнудсона, Мурасига и Скуга, Чеснокова, Кнопа (в зависимости от вида растений) или комплексным минеральным удобрением. По мере роста растений их рассаживают в большие емкости со свежим субстратом. Дальнейшее выращивание акклиматизированных растений соответствует принятой агротехнике выращивания для каждого индивидуального вида растений.
Процесс адаптации пробирочных растений к почвенным условиям является наиболее дорогостоящей и трудоемкой операцией. Нередко после пересадки растений в почву наблюдается остановка в росте, опадение листьев и гибель растений. Эти явления связаны, в первую очередь, с тем, что у пробирочных растений нарушена деятельность устьичного аппарата, вследствие чего происходит потеря большого количества воды. Во-вторых, у некоторых растений в условиях in vitro не происходит образования корневых волосков, что приводит, в свою очередь, к нарушению поглощения воды и минеральных солей из почвы. Поэтому целесообразно на третьем или четвертом этапах клонального микроразмножения применять искусственную микоризацию растений (для микотрофных), учитывая их положительную роль в снабжении растений минеральными и органическими питательными веществами, водой, биологически активными веществами, а также в защите растений от патогенов.
Индийскими учеными предложен простой метод предотвращения быстрого обезвоживания листьев растений, выращенных in vitro, во время их пересадки в полевые условия. Метод заключается в том, что листья в течение всего акклиматизационного периода следует опрыскивать 50%-ным водным раствором глицерина или смесью парафина, или жира в диэтиловом эфире (1:1). Применение этого метода помогает избежать длинных и затруднительных процессов закаливания пробирочных растений и обеспечивает 100%-ную их приживаемость.
Методы клонального микроразмножения
Существует много методов клонального микроразмножения, а также различных их классификаций. Согласно одной из них, предложенной Мурасиге в 1977 году, процесс можно осуществлять следующими путями:
1. Активация пазушных меристем.
2. Образование адвентивных побегов тканями экспланта.
3. Возникновение адвентивных побегов в каллусе.
4. Индукция соматического эмбриогенеза в клетках экспланта.
5. Соматический эмбриогенез в каллусной ткани.
6. Формирование придаточных эмбриоидов в ткани первичных соматических зародышей (деление первичных эмбриоидов).
Н.В. Катаева и Р.Г. Бутенко (1983) выделяют два принципиально различных типа клонального микроразмножения:
1. Активация уже существующих в растении меристем (апекс стебля, пазушные и спящие почки стебля).
2. Индукция возникновения почек или эмбриоидов de novo :
а) образование адвентивных побегов непосредственно тканями экспланта;
б) индукция соматического эмбриогенеза;
в) дифференциация адвентивных почек в первичной и пересадочной каллусной ткани.
Основной метод, использующийся при клональном микроразмножении растений — активация развития уже существующих в растении меристем. Он основан на снятии апикального доминирования.
Этого можно достичь двумя путями: а) удалением верхушечной меристемы стебля и последующим микрочеренкованием побега in vitro на безгормональной среде; б) добавлением в питательную среду веществ цитокининового типа действия, индуцирующих развитие многочисленных пазушных побегов. Как правило, в качестве цитокининов используют 6-бензиламинопурин (БАП) или 6-фурфуриламинопурин (кинетин) и зеатин.
Схема размножения растений методом активации уже существующих меристем (по А. Р. Родину, Е. А. Калашниковой, 1993): 1 – путем удаления верхушечной меристемы: 2 – добавлением цитокининов в среду (б/г – среда без гормонов, Ц – цитокинин, А – ауксин)
Полученные таким образом побеги отделяют от первичного экспланта и вновь самостоятельно культивируют на свежеприготовленной питательной среде, стимулирующей пролиферацию пазушных меристем и возникновение побегов более высоких порядков.
Часто в качестве экспланта используют верхушечные или пазушные почки, которые изолируют из побега и помещают на питательную среду с цитокининами.
Образующиеся пучки побегов делят, при необходимости черенкуют и переносят на свежую питательную среду. После нескольких пассажей, добавляя в питательную среду ауксины, побеги укореняют in vitro, а затем переносят в почву, где создают условия, способствующие адаптации растений.
Адаптация пробирочных роз к почвенным условиям
В настоящее время этот метод широко используется в производстве посадочного материала сельскохозяйственных культур, как технических, так и овощных, а также для размножения культур промышленного цветоводства (например, гвоздики), тропических и субтропических растений, плодовых и ягодных культур, древесных растений.
Станьте нашим автором
Каждый человек — особенный, и опыт каждого — уникален. Расскажите о своем. Заработайте признание и благодарность наших читателей.
Давно хотел рассказать вам о своём посещении мини-лаборатории, где выращивают растения методом in vitro (лат. "в пробирке"). Произошло сие интересное событие в последний день октября уходящего года в Австрии.
Показать полностью…
В часе езды от Вены находится небольшой городок Нойзидль ам Зее (Neusiedl am See), и именно там действует уже несколько лет частная лаборатория по размножению пока только орхидей (на них спрос явно больше, чем на аквариумные растения). Именно размножению, а не выращиванию, поскольку для последнего требуется много места, света и сопутствующих расходов.
Владелица лаборатории Лотте Эдерер, горячо и деятельно поддерживаемая своим супругом (оба профессиональные ботаники), заключила договор о некоммерческом партнёрстве с Венским ботаническим садом, откуда получает заветные коробочки (или стручки) с семенами совсем не тривиальных видов орхидей (среди них, к примеру, много с Мадагаскара). Лотте высевает семена в специальную питательную среду, где — при соблюдении идеальной стерильности и прочих условий содержания — за 6-9 месяцев появляются сеянцы, около 10-20 экземпляров в банке. Определённое количество сеянцев, согласно договору, Лотте передаёт ботаническому саду, пополняя таким образом фонд редких видов. Остатки же реализует любителям — частным посетителям вроде меня или на специализированных выставках-ярмарках.
В моём представлении лаборатория — это сосредоточие разнообразного оборудования, сотрудников в белых халатах, пробирок, реагентов. У фрау Эдерер из оборудования — всего лишь самостоятельно сконструированный стерилизатор, чашечки Петри, небольшой микроскоп и пинцеты. Комнатушка, куда вмещается всё перечисленное выше, не более 10 квадратных метров. Большую её часть занимают стеллажи с растениями, а это — на минуточку — около 200 видов!
При выборе своих орхидей у меня глаза разбежались: приходилось постоянно говорить себе "нет" и мысленно бить себя по рукам, иначе бы весь багаж заняли банки с орхидеями)) В итоге я стал счастливым обладателем нескольких видовых оцеокладесов (Oeceoclades), каттлей, а также таких экзотов, как Ambrella longituba и Broughtonia negrilensis.
вот их сайт, он есть на немецком и на английском http://www.orchideenvermehrung.at/index.htm
ламинар у них есть — самодельный, и это как-раз та невзрачная белая коробка.
Среду готовят на кухне, в кастрюле.
pH не меряют, т.к. используют заранее подготовленную "заводскую" смесь и дистилированную воду.
Показать полностью…
стерилизуют баночки и пробирки, с розлитой по ним питательной средой, в скороварке, 15минут при 120°C b и давлении 0,8бар
у них опыт и посева семенами и размножения спящими почками, причем оба и in vitro и "традиционным" способом — в земле или коре.
Касательно in vitro — они и над паром делали и в ламинаре.
Статьи коротенькие и обильно иллюстрированы. Но не по-русски, понятное дело, но для тех кто умеет в немецкий или английский — вполне сойдет за пособие по размножению.
Могу им написать и спросить разрешения на перевод.
Меристемное размножение в домашней лаборатории запись закреплена
PlantaClub
Сад из пробирки. В Нижнем Новгороде клонируют орхидеи
Сотня разных видов орхидей, в том числе краснокнижных, растят в пробирках в лаборатории ННГУ. Нижегородские ученые не только помогают восстанавливать исчезающие растения, но и клонируют их: полностью или частично.
Показать полностью…
Орхидеи выращивают в подвальном помещении одного из корпусов университета. Лаборатория, созданная в 2009 году в рамках проекта «Национальный университет», занимает пока довольно скромную площадь, порядка пятидесяти квадратных метров. В одной её половине располагается лабораторное и стерильное ламинарное (с биологической защитой) помещения, в другой – культуральная с холодильником и стеллажами с сотнями склянок с растениями. О том, для чего нужно бесчисленное множество «близнецов» одного и того же цветка, корреспонденту NN.RU рассказал молодой ученый, заведующий лабораторией инновационных технологий производства растений НИИ «Ботанический сад» ННГУ Лавр Крюков.
«Мы разрабатываем технологии для размножения видов, которые находятся на грани исчезновения, нужны для сельского хозяйства, фармацевтической промышленности. В общем, тех растений, которые трудно размножаются традиционным способом, проще говоря, семена которых не прорастут, если просто бросить их в землю», — говорит он.
По словам ученого, большинство орхидей внесены в Красную книгу России. Нельзя просто так пойти и накопать их. Так, правда, ещё делают в странах Ближнего Востока, Пакистане, Турции (для изготовления горячего напитка под названием салеп), поскольку в тех странах ещё сохранились многочисленные популяций этих растений, но и там уже экологи бьют тревогу. В России это запрещено законом.
Чтобы проводить эксперименты, нижегородские ученые разработали для растений питательные среды на основе агар-агара — вещества, которое получают из красных и бурых водорослей, растущих в Черном, Белом море и Тихом океане. Из агар-агара также делают мармелад, поскольку он обладает желирующими свойствами. «В среду на основе агар-агара мы добавляем вещества, которые растение получает от гриба», — рассказывает ученый.
Тропики под лестницей
Орхидей в лаборатории порядка ста видов, в том числе тропических и тех, что растут в наших лесах. Это любка двулистая, венерин башмачок, калипсо, ятрышники, офрисы. «Каждое растение имеет свои особенности. Чтобы в природе появилась орхидея, нужно, чтобы в месте, где находится семя, оказался определенный гриб. Рост начинается в результате симбиоза. В противном случае семя просто не прорастает», — объясняет Лавр.
Растения высаживают в Пустынском заказнике и Ботаническом саду, на территории университета. В Ботаническом саду ННГУ одна из самых больших коллекций орхидей в стране. «Больше, наверное, только в Москве: там порядка 2000 видов», — предполагает Лавр. – Почти все, что стоит на стеллажах в лаборатории, — это тропические растения из Юго-Восточной Азии, Африки, Южной Америки». По словам ученого, сложности с выращиванием экзотики нет: главное – питательные среды, уже известные или созданные в лаборатории.
«Воспроизводство орхидей нужно для поддержания коллекционного фонда сада. Часть растений идет в качестве материала для научных и лабораторных работ студентов-ботаников, часть – на обмен с другими ботаническими садами, часть – на подарки», — добавляет нижегородец.
В 2013 году Лавр Крюков и его коллега Галина Зверева основали исследовательское предприятие «Биотехнологический центр «In Vitro», которое выиграло два гранта Правительства по проекту, связанному с клонированием. Нижегородцы знают, как выращивать не целые растения, а лишь необходимую им часть – к примеру, клубни.
«Клубни орхидей содержат питательные вещества, из которых изготавливаются биологически активные добавки, средства для лечения желудка и дыхательной системы. Мы создаем растения-уроды с громадными клубнями и неразвитыми листьями и стеблями», — объясняет Лавр.
Свойства у «клонов» такие же, как у «оригиналов»: ученые не меняют генотип. Исследователи просто создают одно и то же растение много раз. К примеру, из двадцати семян мухоловки в лаборатории было выращено несколько тысяч клонов. «Клонировать ведь можно не только клетку, можно – определенный орган, весь организм», — добавляет ученый.
«Биотехнологический центр «In Vitro» является участником Российско-американского инновационного коридора, международного проекта ННГУ и университета штата Мэриленд, США. Он также заинтересовал швейцарский технопарк BioArk, который сотрудничает с фармацевтическими компаниями. Возможно, в перспективе за рубежом появится «филиал» нижегородской лаборатории.
«В России, к сожалению, довольно узкий спектр компаний, которые могли бы готовить из имеющегося сырья необходимые БАДы и лекарства, изготовить упаковки и так далее и на них сложно выйти. За рубежом таких предприятий, мировых производителей больше», — говорит Лавр Крюков.
Сейчас у государства большая потребность в семенном материале, необходимом для восстановления лесов на месте пожарищ. Клоны для этих целей не подходят: если какой-то вредитель поразит одно дерево, это значит, что затем без труда уничтожит весь лес «близнецов». Зато «близнецов» можно использовать для украшения города летом. Они будут стоить дешевле, чем цветы из торговых сетей, которые привозят из Голландии и Польши.
Растения, выращенные данным способом ничем по качеству не хуже тех, которые продаются в наших магазинах. К тому же это не импорт, соответственно, себестоимость гораздо ниже», — считает Лавр.
В среднем себестоимость выращивания одного растения в лабораторных условиях составляет 15-20 рублей, орхидеи дороже — 50 рублей, так как они содержаться в лабораторных условиях 2-3 года. В магазине орхидеи продают за 300 рублей, цена за коллекционные виды достигает $ 3000.
В НИИ «Ботанический сад ННГУ» планируют построить производственную теплицу, в которой можно будет выращивать посадочный материал из лаборатории и обеспечивать нужды города собственными растениями. А нижегородские ученые перешли к следующему этапу исследований: начали изучать биохимический состав клубней орхидей-«уродов», чтобы определить, сколько в них содержится биологически активных веществ и насколько они подходят для фармацевтического производства.
фото:
1. Тысячи мухоловок
2. Клубни клонированной орхидеи
3. Редкие растения в склянках из-под "Агуши"
Фото:Галина Малова